ペクチン・プロジェクト
「食物繊維」は,ヒトの消化酵素によって分解されることのない天然高分子で,主に多糖類によって構成されています。
この食物繊維がもたらす生理作用は,下図に示すように,主として消化管機能への作用であることが知られています。

ところで,モデル動物を用いた実験で,最近次のような報告がありました。
・食物繊維が腸内細菌に関係なく消化器系組織の杯細胞や陰窩細胞の分化増殖を亢進する
・水溶性食物繊維であるペクチンによって,小腸絨毛の形態変化が起こる
こうした知見は,食物繊維の生理作用がこれまで提唱されてきた副次的なはたらきばかりではなく,直接的に腸管組織細胞にはたらきかけ,細胞がそれに対し応答するという両者の相互作用を示唆していると考えられます。
そこで私たちは,水溶性食物繊維のペクチンを用いて,ヒト小腸上皮細胞モデル細胞であるCaco-2が,非吸収性多糖類に対してどのような細胞応答を示すのか,またその応答機序は何かを解明しようとしています。

上の図は,私たちの仮説を表わしたものです。もし,前述のように細胞が食物繊維であるペクチンに対して応答するのであれば,必ず腸管上皮細胞表面にペクチンの構造を認識する分子が存在するはずです。
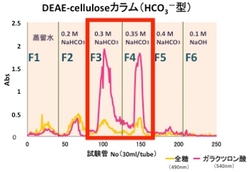
そこでまず,プルーン由来ペクチンの構造を制限するために,DEAE-Cellulose陰イオン交換カラムクロマトグラフィーを用いて,炭酸水素ナトリウムの濃度の違いによる分画を試みました。
すると,右図のように二つの画分に主要な成分(ペクチン)が含まれることが分かり,それぞれ,F3,F4と名付けました。
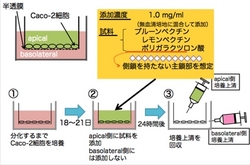
ヒト結腸ガン株化細胞であるCaco-2細胞は,培養条件によりapical(腸管)側とbasolateral(基底面)側に分極することから,腸管上皮様モデル細胞として広く利用されている細胞です。
左図のようにCaco-2細胞を極性化した後,apical側にペクチン(F3またはF4)を添加した際に分泌される蛋白質を調べました。
ペクチンは,ポリガラクツロン酸を主鎖として,ラムノガラクツロナン領域に結合したさまざまな構造から成る側鎖を有する酸性多糖類です。
分極したCaco-2細胞のapicalにプルーンペクチン,レモンペクチン,ポリガラクツロン酸を添加し,24時間後にbasolateralから分泌される蛋白質を二次元電気泳動で分析しました。
その結果,右図に示すように,ポリガラクツロン酸を添加した場合は,コントロールと比較して分泌タンパク質に相違はありませんでしたが,プルーンペクチンとレモンペクチンを添加した場合は,分泌量が変化する蛋白質が確認されました。
ペクチンに対してCaco-2細胞が何らかの応答をしている現象がみられましたが,さらに追求するために,ペクチン添加24時間後の細胞内代謝物の変化を「メタボローム解析」により調べました。
その結果,ペクチン無添加のコントロール群とペクチン添加群を比較した場合,オルニチン回路代謝物の量に変化が確認されました。具体的には,ポリアミンとして知られているプトレシン,スペルミジン,スペルミンの細胞内存在量が減少していました。
ポリアミンは,すべての生物に必須の細胞増殖因子で,細胞内の存在量が厳密に調節されていることも知られています。
ペクチンを摂取したマウスの小腸絨毛の長さや陰窩の深さが大きくなることが報告されていることから,細胞内のポリアミン減少とこうした報告との関連性について,現在研究を進めています。
ペクチンによるCaco-2細胞の応答が確認されたことから,次に,細胞表面に存在する分子を探索する研究を始めました。
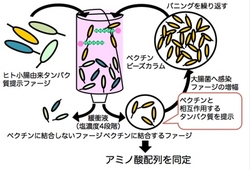
ペクチンとの結合を指標として,目的蛋白質の探索を行うため,ファージディスプレイ法を用いました。
ファージディスプレイ法とは,大腸菌に感染するファージの外殻蛋白質の一種に,蛋白質の遺伝子を導入し,ファージが目的の蛋白質を提示した状態で,標的分子と相互作用させ,最終的に溶出されたファージを大腸菌に感染させて,目的の蛋白質遺伝子を得るという手法です。
私たちは,ヒト小腸由来蛋白質をファージに提出させ,プルーン由来ペクチンと相互作用するものをスクリーニング(この操作をパニングと呼びます)しました。
その結果,細胞外マトリクス蛋白質として知られている「フィブロネクチン」が候補分子として同定されました。
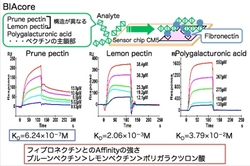
フィブロネクチンが,プルーンペクチン(F3)と結合するかどうかを確認するために,分子間相互作用をBiacoreという装置を用いて調べました。
Biacoreは表面プラズモン共鳴を利用して,分子間の結合力を調べる装置です。その結果,左図に示すように,解離定数からもフィブロネクチンとプルーンペクチンの相互作用が確認されました。
しかも,興味深いことに,レモンペクチンとフィブロネクチンの結合力はプルーンペクチンに比べて非常に小さく,ポリガラクツロン酸との結合力はさらに小さいことが分かりました。
このことから,プルーンペクチン内に存在する特定の多糖構造とフィブロネクチンが特異的に結合していることが推察されました。今後は,この特定の多糖構造を詳細に分析していく必要があります。
フィブロネクチンは,その大部分が基底膜に存在することが知られていることから,腸管側から供給されるペクチンと接触する機会そのものがないように思われます。
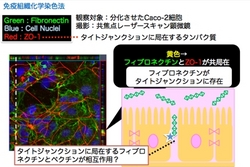
そこで,フィブロネクチンとペクチンが相互作用する場所を特定するために,分極化したCaco-2細胞に対して,フィブロネクチンを蛍光標識し,ペクチン添加時の局在を共焦点レーザー顕微鏡にて観察しました。
その結果,右図に示すように,かなり少数ではあるものの,タイトジャンクションにフィブロネクチンが局在していることが分かりました。ペクチンは,このタイトジャンクション付近に存在するフィブロネクチンと相互作用し,その結果,フィブロネクチンとさらに結合している分子を介して細胞内に情報を伝達している可能性が推察されました。
以上の実験結果を元に,現在はさらに,ペクチンと腸管上皮細胞との情報のやり取りについて研究を進めています。
トラックバック(0)
トラックバックURL: http://work.tomioyabe.net/mt-tb.cgi/112